SECURA NOVA Sp. z o.o.
ul. Marcepanowa 42,
02-962 Warszawa
tel. + 48 602 48 24 61
Dawkowanie leków w nebulizacji
Własności separacyjne spejserów stosowanych w zabiegach inhalacyjnych
Leon Gradoń (1), Tomasz R. Sosnowski (1), Michał Pirożyński (2)
- Wydział Inżynierii Chemicznej i Procesowej Politechniki, Zakład Procesów Podstawowych i Ochrony Środowiska (kierownik Zakładu – prof. dr hab. inż. Leon Gradoń)
- Samodzielna Pracownia Bronchologii Instytutu Gruźlicy i Chorób Płuc w Warszawie (kierownik – prof. dr hab. med. Michał Pirożyński
Terapia aerozolowa jest uważana za jedną z najbardziej obiecujących i skutecznych sposobów w długoterminowym leczeniu schorzeń układu oddechowego. Leczenie inhalacyjne jest formą z wyboru w aplikacji leków – beta 2 mimetyków, steroidów, kromonów w astmie, przewlekłej obturacyjnej chorobie płuc, czy tzw. spastycznym zapaleniu oskrzeli. [1, 9, 14, 15, 28, 32].
Aerozole terapeutyczne wytwarza się w mechanicznych, pneumatycznych lub ultradźwiękowych atomizerach cieczy [14, 17, 36]. Najbardziej powszechnym pozostaje dozownik ciśnieniowy (MDI – metered dose inhaler). W urządzeniach MDI aerozole wytwarza się z ciśnieniowych roztworów lub zawiesin leku w nośniku, którym najczęściej obecnie stosowane są freony (CFC) oraz hydrofluoroalkany (HEA) [5, 6, 13]. Kompozycja zawarta w zbiorniku ciśnieniowym składa się z silnie sproszkowanego leku (lub leku występującego w fazie ciekłej) i niewielkiej ilości surfaktantu zawieszonych lub rozpuszczonych w nośniku. W trakcie uwolnienia zawartości zbiornika do otoczenia i silnej dekompresji zawartości, w powietrzu rozproszone zostają cząstki leku. Doza leku wyzwolonego z MDI w jednym impulsie jest ściśle zdefiniowana przez rodzaj leku, sposób jego występowania oraz konstrukcję zaworu uwalniającego lek ze zbiornika.
Istnieje wiele sprzecznych doniesień co do określenia optymalnej dawki dozowanego leku [40]. Szereg pacjentów, szczególnie niepełnosprawnych, dzieci i osób starszych, ma istotne kłopoty z właściwym stosowaniem MDI [18, 34]. Najczęściej chorzy nie potrafią odpowiednio skoordynować momentu wyzwolenia dawki aerozolu z odpowiednio przeprowadzonym głębokim, powolnym wdechem [34]. Ponadto ponad 90% wyzwolonego leku nie osiąga części oskrzelowej i pęcherzykowej układu oddechowego [7, 15, 17, 25, 29, 32, 34, 36]. Cząstki aerozolu deponują się w nosogardzieli i głośni powodując w konsekwencji efekty uboczne [41].
Próbą zmniejszenia częstości występowania objawów niepożądanych są konstrukcje generatorów wyzwalających dawki generowanego aerozolu pod wpływem własnego wdechu [10, 17] oraz stosowanie tzw. spejserów (przedłużaczy) [14, 20, 26]. Są to proste w konstrukcji elementy przestrzenne umieszczone pomiędzy generatorem aerozolu a pacjentem. Aerozol uwolniony z zasobnika dozownika ciśnieniowego MDI kierowany jest do spejsera, skąd podczas mniej lub bardziej koordynowanego wdechu kierowany jest do układu oddechowego. Wydłużenie drogi dla chmury aerozolu od generatora do nosogardzieli stwarza warunki dla spowolnienia szybkości cząstek aerozolu, tym samym przyczynia się do wytwarzania drobniejszych cząstek, a także zmniejsza podrażnianie tylnej ścianie gardła [20]. Należy podkreślić, że generacja coraz mniejszych cząstek przenikających do obwodowych dróg oddechowych jest bardzo istotna [23]. Obecnie już wiadomo, że najodpowiedniejszymi są te cząstki o średniej średnicy masowej około 1,0 ?m [16, 18, 19, 24, 36, 37, 38, 39].
Trzy podstawowe koncepcje stosowane są przy konstrukcji spejserów: spejsery typu otwartej przelotowej rury, zbiornikowe i spejsery z wymuszonym wstecznym przepływem aerozolu w stosunku do kierunku wdechu. Ponadto spejsery mogą różnić się konstrukcją, kształtem i objętością czynną. Objętość czynna spejserów waha się między 15 a 750 ml.
Polidyspersyjny aerozol wychodzący z generatora po przejściu przez spejser zmienia swój charakter. Na skutek efektów dynamicznych i elektrostatycznych części cząstek aerozolu deponuje się na ściankach spejsera i w obszarze zaworków. W przypadku spejserów niskoobjętościowych, gdzie natężenie przepływu powietrza przez spejser jest duże, o depozycji decydują efekty bezwładnościowe. Duże cząstki na skutek lokalnych zmian kierunku przepływu powietrza wytrącane są z jego strumienia.
W spejserach o dużych objętościach dominującym efektem decydującym o depozycji jest grawitacja i elektrostatyczne osadzanie się cząstek zależne z kolei od materiału spejsera (stała dielektryczna) [22, 42]. Wszystkie te cechy stawiają przed lekarzem trudne zadanie wyboru odpowiedniego spejsera. Ich różne cechy przyczyniają się do różnić w charakterystyce generowanych aerozoli, a tym samym różnej odpowiedzi fizjologicznej zależnej od depozycji cząstek w układzie oddechowym [2, 3, 8, 12, 16, 20, 21, 22, 23, 24, 25, 32, 37].
Celem niniejszej pracy było zbadanie zmian rozkładu średnic aerozolu generowanego z MDI po przejściu przez wybrane, powszechnie stosowane w Polsce, spejsery.
MATETRIAŁ I METODY
SPOSÓB PROWADZENIA POMIARÓW
Jako wzorcowy aerozol do badania wpływu obecności spejsera w układzie inhalacyjnym na rozkład wielkości cząstek stosowano kromoglikan disodowy generowany z dozownika ciśnieniowego (MDI). Badania rozkładu wielkości cząstek aerozolowych prowadzono przy pomocy laserowego licznika cząstek firmy A3 GmbH (RFN). Pomiar z wykorzystaniem tego licznika wymagał odpowiedniego rozcieńczenia aerozolu, które osiągano dzięki zastosowaniu układu zilustrowanego na rys. 1.
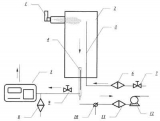
Rysunek 1: Schemat stanowiska pomiarowego.
Aerozol produkowany przez generator MDI (1) ze spejserem lub bez był wprowadzany do komory rozcieńczania (2), w której następowało jego wymieszanie ze strumieniem czystego powietrza doprowadzanego przewodem (3) poprzez filtr absolutny (6). Rozcieńczony aerozol był pobierany do pomiaru przez analizator laserowy (5) za pomocą sondy (4), zaś nadmiarowy strumień rozcieńczonego aerozolu był kierowany na zewnątrz poprzez zawór trójdrożny (10). Natężenie strumienia zasysanego przez licznik było regulowane za pomocą zaworu (9). Aerozol był dodatkowo rozcieńczany przed licznikiem za pomocą powietrza zasysanego porzez filtr absolutny (8). Wstępne zassanie aerozolu wytwarzanego w generatorze pMDI do komory rozcieńczania wymagało chwilowego przełączenia trybu pracy układu z nadciśnieniowego na podciśnieniowy, co osiągano poprzez zamknięcie zaworu (7) i przełączenie zaworu trójdrożnego (10). Wówczas podciśnienie w układzie wytwarzała pompka (12) oraz pompka analizatora (5), które powodowały zasysanie aerozolu z natężeniem przepływu na poziomie 20 l/min. Laserowy licznik cząstek aerozolowych zliczał cząstki z zakresu 0,3-10 mikrometrów (frakcja respirabilna) w 16 kanałach pomiarowych. W wybranym programie pomiarowym czas poboru próbek wynosił 20 sekund. Przed rozpoczęciem każdego pomiaru układ doprowadzano do absolutnej czystości (liczba cząstek w powietrzu zasysanym przez licznik w ciągu pół minuty była równa 0), a następnie dokonywano przełączenia układu na podciśnienie i wyzwalano dawkę aerozolu. Po przywróceniu dopływu powietrza rozcieńczającego włączano pobór próbki przez licznik A3 i uruchamiano pomiar. Dla każdego typu spejsera wykonywano 5 niezależnych pomiarów. Wykonano również badania tła tj. przy przeprowadzeniu wszystkich czynności związanych z normalnym pomiarem, ale bez wyzwolenia dawki leku. Wykazały one, że liczba obcych cząstek dostających się do układu podczas czynności związanych z przełączaniem ciśnień jest minimalna (głównie cząstki submikronowe w ilości poniżej 0,5% liczby cząstek notowanych po wyzwoleniu generatora), co pozwala w zupełności zaniedbać ten efekt. W ramach pracy przebadano generację leku wziewnego (kromoglikanu dwusodowego) z generatora ciśnieniowego (MDI) bez spejsera oraz połączonego z kilkoma typami spejserów niskoobjętościowych (pojemność ok. 0,2 dm3) oraz wysokoobjętościowych (pojemność ok. 1 dm3).
Badania prowadzono w temperaturze pokojowej. Wyniki pomiarów zostały poddane obróbce komputerowej, w wyniku której zostały znormalizowane (liczba zleceń w danym kanale pomiarowym została odniesiona do jego szerokości), a następnie posłużyły do określenia procentowych masowych rozkładów wielkości cząstek w strumieniu badanego aerozolu oraz do wyznaczenia średniej masowej średnicy cząstek w każdym z badanych układów generacji.
Dodatkowo oznaczono rozkład cząstek wytwarzanych z dozownika ciśnieniowego (MDI) w pełnym zakresie wielkości (tzn. nie tylko w zakresie respirabilnym). W tym celu skorzystano z innego licznika laserowego (A3 GmbH, RFN), analizującego w zakresie 2-85 mikrometrów rozkład wielkości cząstek stałych zawieszonych w cieczy. Wyzwalany z MDI strumień aerozolu był pochłaniany przez wodę i natychmiast poddawany analizie (czas od wprowadzenia cząstek leku do cieczy do chwili wykonania pomiaru nie przekraczał 10 sekund). Pomiar ten wskazał, jaka część atomizowanego leku znajduje się poza zakresem inhalacyjnym.
WYNIKI
Dla jakościowej analizy depozycji cząstek aerozolowych w obszarze spejsera należy rozważyć możliwe efekty oddziaływania na cząstki. Podczas przepływu aerozolu przez spejser (rys. 2) cząstka ulega depozycji na skutek: dyfuzji, grawitacji, bezwładności i oddziaływań elektrostatycznych.
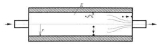
Rysunek 2: Mechanizmy depozycji cząstek aerozolowych w spejserze
Dla cząstek małych o depozycji na ściankach spejsera decyduje dyfuzja i efekt elektrostatyczny. Strumień J cząstek docierających do ścianki można wyrazić jako:
WZÓR
(1), gdzie współczynnik dyfuzji cząstek, D~1/d, jest odwrotnie proporcjonalny do ich średnicy, a gradient stężenia na ściance, n/ r, zależy od liniowej szybkości przepływu aerozolu przez spejser. Całkowity efekt dyfuzyjny będzie zależny od wielkości cząstek i czasu przebywania w obszarze spejsera, a więc jego objętości i natężenia przepływu powietrza przez spejser (intensywności oddechu).
Efekt elektrostatyczny (ce·n) zależy od oddziaływań elektrostatycznych, ce~ne·E/d, które z kolei zależą od ładunku cząstki, potencjału elektrody (ścianki spejsera) oraz wielkości cząstki. Na ściance spejsera wyłapywane będą małe cząstki niosące duży ładunek dla przypadku dużego potencjału ścianki. Potencjał elektryczny ścianki zależeć będzie od materiału, z którego zbudowany jest spejser (stała dielektryczna) i szybkości przepływu powietrza wywołującego ładunek elektryczny na ściance na skutek tarcia. W spejserach przestrzennych o dużych powierzchniach ścianki wykonanych z materiałów dielektrycznych (tworzyw sztucznych) osadzać się będą małe cząstki. Zostaną one wydzielone ze strumienia aerozolu podawanego z generatora.
Głównymi efektami oddziaływującymi na cząstki duże jest grawitacja i bezwładność. Charakterystyczna szybkość osadzania grawitacyjnego, ce~g·d2, silnie zależy od wielkości cząstek. Dla materiału o gęstości 1 g/cm3 szybkość sedymentacji dla cząstki o średnicy 10 µm. wynosi 0,3 cm/s, a dla 50 µm. - już 7cm/s. W przypadku średnich i dużych cząstek o depozycji decyduje efekt bezwładnościowy charakteryzowany liczbą Stokesa, Stk-d2·U, silnie zależną od średnic cząstek, d, i liniowej prędkości aerozolu, U.
Tak więc stosunkowo duże cząstki przepływające przez spejser z dużą prędkością będą łatwiej w nim usuwane.
Pierwotny rozkład wielkości cząstek z generatora aerozolu, po przejściu przez spejser modyfikuje się na skutek eliminacji cząstek odpowiednich rozmiarów. Zależnie od konstrukcji spejsera udział poszczególnych efektów wpływających na eliminację cząstek jest różny.
W spejserach niskoobjętościowych o krótkich czasach przebywania eliminowane są cząstki średnie i duże. W spejserach przestrzennych wykonanych z materiałów dielektrycznych eliminowane są cząstki bardzo małe (dyfuzja) i duże (sedymentacja). Biorąc pod uwagę skuteczność depozycji cząstek w płucach, spejser powinien pracować w ten sposób, żeby aerozol po przejściu przezeń zawierał duży udział frakcji respirabilnej.
W aparaturze przedstawionej wyżej i według opisanej procedury zbadano szereg typów spejserów klasyfikując je w dwie grupy - niskoobjętościowe (A) i wysokoobjętościowe (B). Aerozolem pierwotnym były cząstki kromoglikanu disodowego generowanego z inhalatora ciśnieniowego z MDI. Skumulowany rozkład wielkości cząstek pokazano na rys.2. Oznacza on udział procentowy (masowo) cząstek do danego, wybranego rozmiaru. Największe identyfikowane cząstki miały średnicę 85 µm. Udział masowy frakcji cząstek do 10 µm., które mogą być rozważane jako cząstki mogące jeszcze penetrować do drzewa oskrzelowego, stanowi w badanym przypadku 30% ogółu cząstek.
Biorąc średni czas przebywania aerozolu w obszarze spejsera oraz charakterystyczne czasy sedymentacji, określające efekt usuwania cząstek na skutek grawitacji i liczby Stokesa, określające efekt bezwładnościowy usuwania cząstek, okazuje się, że zdecydowana wielkość cząstek o średnicy powyżej 10 µm. pozostaje osadzona na ściankach i dodatkowych elementach (zaworki) spejsera. Dalszą modyfikację rozkładu ograniczono więc do frakcji cząstek o średnicach do 10 µm. W pierwszej części badano rozkład wielkości cząstek tej frakcji w aerozolu wygenerowanym z MDI, a następnie badano rozkłady wielkości cząstek po przejściu przez spejsery. Wyznaczono również średnie średnice masowe generowanego aerozolu.
Na rys.3 pokazano zmiany średniej średnicy cząstek po przejściu przez spejsery niskoobjętościowe (A) i wysokoobjętościowe (B), w stosunku do aerozolu źródłowego pMDI. Średnie masowe średnice dla spejserów małoobjętościowych wśród których zbadano Optihaler, Optichamber i Aerochamber, średnia średnica cząstek jest wyraźnie obniżona w stosunku do pMDI. Oznacza to, że w spejserach niskoobjętościowych na skutek efektów głównie bezwładnościowych usuwane są w różnym stopniu cząstki o średnicach powyżej 3 µm i spektrum rozkładu przesuwa się w kierunku cząstek mniejszych. Jednocześnie ze względu na czas przebywania i dużą ruchliwość cząstek małych nie są one usuwane na skutek efektu dyfuzyjnego i elektrostatycznego. Widać to zwłaszcza na rys.4 gdzie pokazano zmiany udziałów procentowych cząstek o wybranych rozmiarach: 0,35 µm, 0.6 µm, 1,5 µm, 3 µm i 10 µm po przejściu przez spejser niskoobjętościowy (jasne słupki) w stosunku do pMDI.

Rysunek 3: Rozkład skumulowany kromoglikanu disodowego genrowanego z dozownika ciśnienowego (MDI)
Niewielki wzrost udziałów masowych cząstek do 1,5µm dokonał się na skutek niewielkiej względnej zmiany udziału cząstek większych (ok. 10 µm).
Wykres 3 jest charakterystyczny dla wszystkich spejserów niskoobjętościowych wymienionych wyżej.
Na rys.3 pokazano również, poprzez analizę średniej średnicy masowej, jak modyfikują aerozol spejsery wysokoobjętościowe (B). Otóż w porównaniu z pMDI średnia średnica masowa co prawda niewiele, ale wzrosła. Odbyło się to kosztem zmniejsza udziału małych cząstek (liczbowo możliwie dużej ilości). Po przejściu przez spejser wysokoobjętościowy cząstki małe osadziły się na ściankach na skutek efektu dyfuzyjnego i elektrostatycznego.
DYSKUSJA
W podsumowaniu należałoby stwierdzić, że spejsery modyfikują pierwotny rozkład aerozolu generowanego przez atomizery MDI. Spejsery niskoobjętościowe przesuwają rozkład w kierunku cząstek mniejszych.

Rysunek 4: Średnia średnica masowa aerozolu kromoglikanu disodowego genrowanego z dozownika ciśnienowego (MNDI).
Zgodnie z najnowszymi badaniami nad depozycja cząstek, frakcja cząstek o mniejszych średnicach łatwiej penetruje do oskrzelików końcowych i pęcherzyków płucnych osadzających się tam ze stosunkowo dużą skutecznością. Z tego punktu widzenia stosowanie spejserów niskoobjętościowych może poprawić efekt terapeutyczny. W rozważaniach przedstawionych powyżej nie analizowano wpływu objętości spejsera na możliwość koordynacji oddechowej i sposobu pobierania aerozolu z obszaru spejsera, co również może mieć wpływ na całkowitą depozycję cząstek w płucach.
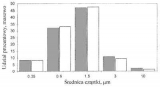
Rysunek 5: Masowy udział procentowy poszczególnych frakcji cząstek dla samego dozownika ciśnieniowego (MDI) [ciemne słupki] oraz dla dozownika ciśnieniowego (MDI) z spejserem niskoobjętościowym [jasne słupki]
Spejsery spełniają bardzo istotną rolę w aerozoloterapii. Nie tylko zmniejszają częstość występowania objawów niepożądanych, ale również jak wykazaliśmy znacząco zwiększają udział frakcji respirabilnej we wdychanym aerozolu oraz spełniają istotną rolę leczeniu przewlekłych schorzeniach zapalnych układu oddechowego [11].
Piśmiennictwo:
- Anderson S.D., Seale J.P., Rozea P., Bandler L., Theobald G., Lindsay D.A.: Inhaled and oral salbutamol in exercise-induced asthma. Am. Rev. Respir. Dis. 1976, 114, 493-500.
- Barry P.W., O'Callaghan C.: In vitro comparison of the amount of salbutamol available for inhalation from different formulations used with different spacer devices. Eur. Respir. J. 1997, 10, 1345-1348.
- Berkowitz R., Rachelefsky G., Harris A.G., Chen R.: A comparison of triamcinolone acetonide MDI with a built- in tube extender and beclomethasone dipropionate MDI in adult asthmatics. Chest 1998, 114, 757-765.
- Bisgaard H.: Automatic actuation of a dry powder inhaler into a nonelectrostatic spacer. Am. J. Respir. Crit. Care Med. 1998, 157, 518-521.
- Bleecker E.R., Tinkelman D., Klinger N., Ekholm B.: Long term efficacy and safety study of the HFA-134a salbutamol sulfate, CFC-11/12 salbutamol (Ventolin) and HFA-134a placebo in patients with asthma. Am. J. Respir. Crit. Care Med.1995, xxx, suppl, ...
- Bronsky E.A., Colice G.L., Ekholm B., Senta T.A., Wagenknecht K.A., Elstad N.L.: Four week safety and efficacy study of HFA salbutamol and CFC salbutamol metered dose inhalaers in children with asthma. Am. J. Respir. Crit. Care Med. 1995, siupll. Xxxxxxx.
- Campos A., Diaz M.A., Munoz M.P., Linana J.J., Martinez M., Lanuza M.D.: Assessment of the inhalation technique in asthmatic patients: a comparative study of three aerosol devices. Allergol. Immunopathol.(Madr). 1998, 26, 47-51.
- Clark D.J., Lipworth B.J.: Effect of multiple actuations, delayed inhalation and antistatic treatment on the lung bioavailability of salbutamol via a spacer device. Thorax 1996, 51, 981-984.
- Cockcroft D.W., Killian D.N., Mellon J.J.A., Hargreave F.E.: Protective effect of drugs on histamine induced asthma. Thorax 1977, 32, 429-437. 10. Corr D., Doilovich M., McCormack D., Ruffin R.,
- Obminski G., Newhouse M.: Design and characteristics of a portable breath actuated, particle size selective medical aerosol inhaler. J. Aerosol. Sci. 1982, 13, 1 – 7.
- Cunningham S.J., Crain E.F.: Reduction of morbidity in asthmatic children given a spacer device. Chest 1994, 106, 753 – 757.
- Dalby R.N., Somaraju S., Chavan V.S., Jarvis D.: Evaluation of aerosol drug output from the OptiChamber and AeroChamber spacers in a model system. J. Asthma 1998, 35, 173-177.
- Dockhorn R.J., Wagner D.E., Burgess G.L., Hafner K.B., Letourneau K., Colice G.L., Klinger N.M.: Proventil HFA provides protection from exercise induced bronchoconstriction comparable to proventil and ventolin. Ann. Allergy Asthma Immunol. 1997, 79, 85-88.
- Dolovich M.: Inhalation technique and inhalation devices, w: Beta 2 agonists in asthma treatment (red. R. Pauwels, P.M.O’Byrne), Marcel Dekker, Inc., New York 1997, 229 – 251.
- Dolovich M.: Aerosols w: Asthma (pod redakcją P.J. Barnes, M.M. Grunstein, A.R. Leff, A.J. Woolcock), Lippincott-Raven Publishers, Philadelphia 1997, 1349-1366.
- Golish J., Curtis-McCarthy P., McCarthy K., Kavuru M., Wagner W., Beck G., Eng P.: Albuterol delivered by metered-dose inhaler (MDI), MDI with spacer, and Rotahaler device--a comparison of efficacy and safety. J. Asthma 1998, 35, 373-379.
- Gradoń L.: Optymalizacja warunków podawania leków metodami wziewnymi w: Postępy w aerozoloterapii (red. T.Płusa), Medpress, Warszawa 1996, 18 – 26.
- Gradoń L., Sosnowski T.R., Pirożyński M.: Charakterystyka aerozoli wytwarzanych w generatorze Easi Breathe. Post. aerozoloterapii 1998, 6, 9-20.
- Gross G., Thompson P.J., Chervinsky P., Burgt J.V.: Hydrofluoroalkane-134a beclomethasone dipropionate, 400 mcg is as effective as chlorofluorocarbon beclomethasone dipropionate, 800 mcg, for the treatment of moderate asthma. Chest 1999, 115, 343 – 351.
- Gunawardena K.A., Sohal T., Jones J.I., Upchurch F.C., Crompton G.K.: The Spacehaler for delivery of salbutamol: a comparison with the standard metered-dose inhaler plus Volumatic spacer device. Respir. Med. 1997, 91, 311-316.
- Hendriks H.J., Overberg P.C., Brackel H.J., Vermun N.A.: Handling of a spacer (Babyhaler) for inhalation therapy in 0- to 3-year-old children. J. Asthma 1998, 35, 297-304.
- Kenyon C.J., Thorsson L., Borgstrom L., Newman S.P.: The effects of static charge in spacer devices on glucocorticosteroid aerosol deposition in asthmatic patients. Eur. Respir. J. 1998, 11, 606-610.
- Kraft M., Djukanovic R., Wilson S., Holgate S.T., Martin R.J.: Alveolar tissue inflammation in asthma. Am. J. Respir. Crit. Care Med. 1996, 154, 1505-1510.
- Lipworth B.J., Clark D.J.: Early lung absorption profile of non-CFC salbutamol via small and large volume plastic spacer devices. Br. J. Clin. Pharmacol. 1998, 46, 45 – 48.
- Lipworth B.J., Clark D.J.: Lung delivery of salbutamol by dry powder inhaler (Turbuhaler) and small volume, antistatic, metal spacer (Airomir CFC-free MDI plus NebuChamber). Eur. Respir. J. 1998, 10, 1820-1823.
- Matthys H., Umile A.: Holding chambers for pMDI use. Drugs Exp. Clin. Res. 1997, 23, 183 – 189.
- Newhouse M.T.: Inhalation drug delivery from seven different spacer devices [letter to editor]. Thorax 1997, 52, 585-586.
- Newman S.P., Brown J., Steed K.P., Reader S.J., Kladders H.: Lung deposition of fenoterol and flunisolide delivered using a novel device for inhaled medicines: comparison of RESPIMAT with conventional metered-dose inhalers with and without spacer devices. Chest 1998, 113, 957-963.
- Newman S.P., Pavia D., Moren F., Sheahan N.F., Clarke S.W.: Deposition of pressurised aerosols in the human respiratory tract. Thorax 1981, 36, 52-55.
- O'Callaghan C.: Delivery systems: the science. Pediatr. Pulmonol. Suppl. 1997, 15, 51-54.
- O'Reilly J.F., Weir D.C., Banham S., Basran G.S., Boyd G., Patel K.R.: Is high-dose fluticasone propionate via a metered-dose inhaler and Volumatic as efficacious as nebulized budesonide in adult asthmatics? Respir. Med. 1998, 92, 111-117.
- Pauwels P., Newman S., Borgström L.: Airway deposition and airway effects of antiasthma drugs delivered from metered dose inhalers. Eur. Respir. J. 1997, 10, 2127-2138.
- Pedersen S.: Inhalers and nebulizers: which to choose and why. Respir. Med. 1996, 90, 69-77.
- Pirożyński M.: Dozownik ciśnieniowy (pMDI) idealnym generatorem aerozolu? Post. Aerozoloterapii 1998, 6, 65-75.
- Pirożyński M.: Aerozoloterapia w chorobach układu oddechowego u dorosłych, w: Leczenie inhalacyjne i rehabilitacja układu oddechowego u dzieci i dorosłych (pod redakcją J. Alkiewicza), Volumed, Wroclaw 1995, 189-190.
- Pirożyński M.: Aerozoloterapia we współczesnej pulmonologii. Streszczenia II Sympozjum Naukowo - Szkoleniowy "Postępy w zakresie diagnostyki i leczenia chorób alergicznych". Rabka 1994, 77-80.
- Pirożyński M.: Różne systemy inhalacyjne drogą do sukcesu w leczeniu astmy oskrzelowej. V Sympozjum Naukowo-Szkoleniowe „Postępy w zakresie diagnostyki i leczenia chorób alergicznych. Kraków 4 – 7.03.1998. Materiały konferencji na CD
- Pirożyński M.: Blaski i cienie różnych metod generacji aerozoli leczniczych. V Sympozjum Naukowo-Szkoleniowe „Postępy w zakresie diagnostyki i leczenia chorób alergicznych. Kraków 4 – 7.03.1998. Materiały konferencji na CD
- Pirożyński M.: Blaski i cienie dozownika ciśnieniowego pMDI. Acta Pneumonologica et Alergologica Pediatrica 1998, 1, 6 – 8
- Riley D.J., Weitz B.W., Edelman N.H.: The responses of asthmatic subjects to isoproterenol inhaled at different lung volumes. Am. Rev. Respir. Dis. 1976, 114, 509-515.
- Toogood J.H., Jennings B., Greenway R.W., Chuang L.: Candidiasis and dysphonia complicating beclomethasone treatment of asthma. J. Allergy Clin. Immunol. 1980, 65(2):145-153.
- Wildhaber J.H., Devadason S.G., Hayden M.J., James R., Dufty A.P., Fox R.A., Summers Q.A., LeSounf, P.N.: Electrostatic charge on a plastic spacer device influences the delivery of salbutamol. Eur. Respir. J. 1996, 9, 1943-1946.
Zobacz pozostałe wpisy


 Dawkowanie leków w nebulizacji
Dawkowanie leków w nebulizacji

